По истечению срока патента на препарат другие производители могут проводить исследования, подтверждающие равную эффективность между оригинальным лекарственным средством и дженериком. «Качественный генерик» обладает терапевтической взаимозаменяемостью с оригинальным препаратом. Однако терапевтическую эквивалентность воспроизведенного препарата изучают редко, так как законодательные правила их регистрации этого не требуют и не обязывают проводить сравнительные клинические испытания.
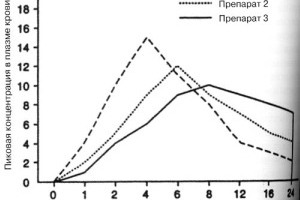
Соответствие препаратов доказывают в первую очередь на основании так называемой фармацевтической эквивалентности (изучается по критерию растворимости по «Тесту растворения», in vitro) и фармакокинетической эквивалентности, или биоэквивалентности. Это исследование проводится в сертифицированных фармакологических центрах с участием здоровых добровольцев. Оно отражает эффективность и безопасность «качественного дженерика», в сравнении с оригинальным лекарственным средством.
В эксперименте в качестве препарата сравнения, как правило, используется оригинальный препарат как отечественного, так и зарубежного производства. Исследуемые препараты в одинаковой лекарственной форме должны приниматься в равных разовых дозировках. После этого, исследователи получают экспериментальные данные, отражающие концентрацию действующего вещества в крови, и анализируют по основным фармакокинетическим параметрам. Для установления биоэквивалентности сопоставляют полученные результаты в опытах in vivo или in vitro между оригинальным и воспроизведенным средствами. При выявлении корреляции, исследуемые препараты считаются биоэквивалентными.
Таким образом, после истечения срока действия патента на оригинальный препарат можно создать дженерики и выводить их на фармацевтический рынок для реализации населению.









Чтобы оставить комментарий, необходимо авторизоваться